Применение алканов формулы. Алканы — предельные углеводороды, их химические свойства. Химические свойства циклоалканов
Алканы или алифатические насыщенные углеводороды - соединения с открытой (нециклічним) цепью, в молекулах которых атомы углерода соединены между собой σ-связью. Атом углерода в алканах находятся в состоянии sp 3 -гибридизации.
Алканы образуют гомологический ряд, в котором каждый член отличается на постоянную структурную единицу -CH 2 -, что называется гомологической разностью. Простейший представитель - метан CH 4 .
- Общая формула алканов: C n H 2n+2
Для алканов кроме структурной существует конформационная изомерия и начиная с гептана - енантіомерія:

Номенклатура IUPAC В названиях алканов используют префиксы н- , втор- , изо , трет- , нео :
- н- означает нормальную (нерозгалужену) строение углеводородного цепи;
- втор- применяется только для вторичного бутила;
- трет- означает алкил третичной структуры;
- изо разветвления на конце цепи;
- нео используется для алкілу с четвертичным атомом углерода.
Номенклатура разветвленных алканов построена основана на следующих основных правилах:
- Для построения названия выбирают длинную цепь атомов углерода и нумеруют его арабскими цифрами (локантами), начиная с конца, ближе к которому находится заместитель, например:

- Если одна и та же алкільна группа встречается более одного раза, то в названии перед ней ставят помножуючі приставки ди- (перед гласной ди- ), три- , тетра- и т. п. и обозначают цифрой каждый алкил отдельно, например:

Необходимо заметить, что для сложных остатков (групп) применяются помножуючі префиксы вроде бис- , трис- , тетракіс- прочее.
- Если в боковых ответвлениях главной цепи размещены различные алкіли-заместители, то их переразовують по алфавиту (при этом помножуючі приставки ди- , тетра- и т. п, а также префиксы н- , втор- , трет- не принимают во внимание), например:

- Если возможны два или более вариантов длиннейшей цепи, то выбирают тот, который имеет максимальное количество боковых разветвлений.
- Названия сложных алкильных групп строятся по тем же принципам, что и названия алканов, но нумерация цепи алкілу всегда автономна и начинается с того атома углерода, имеющего свободную валентность , например:

- При использовании в названии такой группы ее берут в скобки и в алфавитном порядке учитывается первая буква названия всей:

Промышленные методы добычи 1. Извлечения алканов газа. Природный газ состоит главным образом из метана и небольших примесей этана, пропана, бутана. Газ под давлением при пониженных при пониженных температурах разделяют на соответствующие фракции.
2. Извлечения алканов из нефти. Сырую нефть очищают и подвергают переработке (розгонка, фракціювання, крекинг). Из продуктов переработки получают смеси или индивидуальные соединения.
3. Гидрирование угля (метод Ф. Бергіуса, 1925 г.). Каменный или бурый уголь в автоклавах при 30 МПа в присутствии катализаторов (оксиды и сульфиды Fe, Mo, W, Ni) в среде углеводородов гидрированные и превращаются в алканы, так называемое моторное топливо:
nC + (n+1)H 2 = C n H 2n+2
4. Оксосинтеза алканов (метод Ф. Фишера - Г. Тропша, 1922 г.). По методу Фишера - Тропша алканы получают из синтез-газа. Синтез-газ представляет собой смесь CO и H 2 с различным соотношением. Его получают из метана одной из реакций, которые происходят при 800-900°C в присутствии оксида никеля NiO, нанесенного на Al 2 O 3:
CH 4 + H 2 O ⇄ CO + 3H 2
CH 4 + CO 2 ⇄ 2CO + 2H 2
2CH 4 + O 2 ⇄ 2CO + 4H 2
Алканы получают по реакции (температура около 300°C, катализатор Fe-Co):
nCO + (2n+1)H 2 → C n H 2n+2 + nH 2 O
Образованная смесь углеводородов, состоящая в основном из алканов строения (n=12-18), называют "синтином".
5. Сухая перегонка. В относительно небольших количествах алканы получают при помощи сухой перегонки или нагрева угля, сланцев, древесины, торфа без доступа воздуха. Примерный состав полученной смеси при этом составляет 60% водорода, 25% метана и 3-5% этилена.
Лабораторные методы добывания 1. Получение из галогеналкілів
1.1. Взаимодействие с металлическим натрием (Вурц, 1855 г.). Реакция состоит во взаимодействии щелочного металла с галогеналкілом и применяется для синтеза высших симметричных алканов:
2CH 3 -I + 2Na ⇄ CH 3 -CH 3 + 2NaI
В случае участия в реакции двух разных галогеналкілів образуется смесь алканов:
3CH 3 -I + 3CH 3 CH 2 -I + 6Na → CH 3 -CH 3 + CH 3 CH 2 CH 3 + CH 3 CH 2 CH 2 CH 3 + 6NaI
1.2 Взаимодействие с літійдіалкілкупратами. Метод (иногда называют реакцией Е. Коре - Х. Хауса) заключается во взаимодействии реакционноспособных літійдіалкілкупратів R 2 CuLi с галогеналкілами. Сначала происходит взаимодействие металлического лития с галогеналканом в среде эфира. Далее соответствующий алкіллітій реагирует с галогенідом меди(I) с образованием растворимого літійдіалкілкупрату:
CH 3 Cl + 2Li → CH 3 Li + LiCl
2CH 3 Li + CuI → (CH 3 ) 2 CuLi + LiI
При взаимодействии такого літійдіалкілкупрату с соответствующим галогеналкілом образуется конечное соединение:
(CH 3 ) 2 CuLi + 2CH 3 (CH 2 ) 6 CH 2 -I → 2CH 3 (CH 2 ) 6 CH 2 -CH 3 + LiI + CuI
Метод позволяет достичь выхода алканов почти 100% при применении первичных галогеналкілів. При их вторичной или третичной строении выход составляет 30-55%. Природа алкільної составляющей в літійдіалкілкупраті мало влияет на выход алкану.
1.3 Восстановление галогеналкілів. Восстанавливать галогеналкіли возможно каталитически возбужденным молекулярным водородом, атомарным водородом, йодоводнем тому подобное:
CH 3 I + H 2 → CH 4 + HI (катализатор Pd)
CH 3 CH 2 I + 2H → CH 3 CH 3 + HI
CH 3 I + HI → CH 4 + I 2
Метод имеет препаративне значение, часто используют сильный восстановитель - йодоводень.
2. Получение из солей карбоновых кислот.
2.1 Электролиз солей (Кольбе, 1849 г.).
Реакция Кольбе заключается в электролизе водных растворов солей карбоновых кислот:
R-COONa ⇄ R-COO - + Na +
На аноде анион карбоновой кислоты окисляется, образуя свободный радикал, и легко декарбоксилюється или отщеплять CO 2 . Алкильные радикалы далее вследствие рекомбинации превращаются в алканы:
R-COO - → R-COO . + e -
R-COO . → R . + CO 2
R . + R . → R-R
Препаративный метод Кольбе считается эффективным при наличии соответствующих карбоновых кислот и невозможности применить другие методы синтеза.
2.2 Сплавления солей карбоновых кислот со щелочью. Соли щелочных металлов карбоновых кислот при славленні с щелочью образуют алканы:
CH 3 CH 2 COONa + NaOH → Na 2 CO 3 + CH 3 CH 3
3. Восстановление кислородсодержащих соединений (спиртов, кетонов, карбоновых кислот). Восстановителями выступают вышеупомянутые соединения. Чаще всего применяют йодоводень, который способен восстанавливать даже кетоны: Первые четыре представителя алканов от метана до бутана (C 1 -C 4) - газы, от пентана до пентадекану (C 5 -C 15 - жидкости, от гексадекану (C 16) - твердые вещества. Увеличения их молекулярных масс приводит к увеличению температур кипения и плавления, при чем алканы с разветвленной цепью кипят при более низкой температуре, чем алканы нормального строения. Это объясняется меньшей вандерваальсівською взаимодействием между молекулами разветвленных углеводородов в жидком состоянии. Температура плавления четных гомологов выше по сравнению с температурой соответственно для нечетных.
Алканы гораздо легче за воду, неполярные и трудно поляризуются, однако растворимы в большинстве неполярных растворителей, благодаря чему сами могут быть растворителем для многих органических соединений.
Алканы с химической точки зрения представляют собой углеводороды, то есть общая формула алканов включает в себя исключительно атомы углерода и водорода. Помимо того, что эти соединения не содержат никаких функциональных групп, они образуются только за счет одинарных связей. Такие углеводороды называются насыщенными.
Типы алканов
Все алканы можно выделить в две большие группы:
- Алифатические соединения. Их структура имеет вид линейной цепочки, общая формула алканов алифатического типа C n H 2n+2 , где n - количество атомов углерода в цепи.
- Циклоалканы. Эти соединения имеют циклическую структуру, что обуславливает существенное отличие их химических свойств от линейных соединений. В частности, структурная формула алканов этого типа обуславливает сходство их свойств с алкинами, то есть углеводородами с тройной связью между атомами углерода.
Электронная структура алифатических соединений
Эта группа алканов может иметь либо линейную, либо разветвленную углеводородную цепь. Их химическая активность является невысокой по сравнению с другими органическими соединениями, поскольку все связи внутри молекулы являются насыщенными.
Молекулярная формула алканов алифатического типа говорит о том, что их химическая связь имеет sp 3- гибридизацию. Это означает, что все четыре ковалентные связи вокруг атома углерода по своим характеристикам (геометрическим и энергетическим) являются абсолютно равноправными. При таком типе гибридизации электронные оболочки уровней s и p атомов углерода имеют одинаковую форму вытянутой гантели.
Между атомами углерода связь в цепи является ковалентной, а между атомом углерода и водорода она частично поляризована, при этом электронная плотность оттягивается к углероду, как к элементу более электроотрицательному.
Из следует, что в их молекулах существуют только связи C-C и C-H. Первые образуются в результате перекрывания двух электронных гибридизованных орбиталей sp 3 двух атомов углерода, а вторые образуются при перекрывании орбитали s водорода и орбитали sp 3 углерода. Длина связи C-C равна 1,54 ангстрема, а связи C-H - 1,09 ангстрема.
Геометрия молекулы метана
Метан является самым простым алканом, который состоит всего из одного атома углерода и четырех атомов водорода.
Благодаря энергетической равноправности его трех 2p и одной 2s орбиталей, полученной в результате sp 3 -гибридизации, все орбитали в пространстве расположены под одинаковым углом друг к другу. Он равен 109,47°. В результате такой молекулярной структуры в пространстве образуется подобие треугольной равносторонней пирамиды.

Простые алканы
Самым простым алканом является метан, который состоит из одного атома углерода и четырех атомов водорода. Следующие в ряду алканов за метаном пропан, этан и бутан образованы тремя, двумя и четырьмя атомами углерода соответственно. Начиная с пяти атомов углерода в цепи, соединения получили название согласно номенклатуре ИЮПАК.
Таблица с формулами алканов и их названиями приведена ниже:
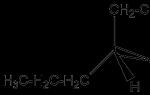
При потере одного водородного атома у молекулы алкана образуется активный радикал, окончание которого меняется с "ан" на "ил", например, этан C 2 H 6 - этил C 2 H 5 . Структурная формула алкана этана приведена на фото.

Номенклатура органических соединений
Правила определения названий алканов и соединений на их основе установлены международной номенклатурой ИЮПАК. Для органических соединений действуют следующие правила:
- Название химического соединения базируется на названии его самой длинной цепи из атомов углерода.
- Нумерацию атомов углерода следует начинать с конца, ближе к которому начинается разветвление цепи.
- Если в соединении присутствуют две или более углеродные цепи одинаковой длины, то в качестве основной выбирается та, которая имеет меньше всего радикалов, и они имеют более простую структуру.
- Если в молекуле имеются две и более одинаковые группы радикалов, тогда в названии соединения используются соответствующие префиксы, которые удваивают, утраивают и так далее названия указанных радикалов. Например, вместо выражения "3-метил-5-метил" используется "3,5-диметил".
- Все радикалы записываются в алфавитном порядке в общее название соединения, при этом префиксы не берутся во внимание. Последний радикал пишется слитно с названием самой цепи.
- Числа, отражающие номера радикалов в цепи, отделяются от названий дефисом, а сами цифры записываются через запятую.
Соблюдение правил номенклатуры ИЮПАК позволяет легко определить молекулярную формулу алкана по например, 2,3-диметилбутан имеет следующий вид.

Физические свойства
Физические свойства алканов во многом зависят от длины углеродной цепи, образующей конкретное соединение. Основными свойствами являются следующие:
- Первые четыре представителя, согласно общей формуле алканов, при нормальных условиях находятся в газообразном состоянии, то есть это бутан, метан, пропан и этан. Что касается пентана и гексана, то они существуют уже в виде жидкостей, а начиная с семи атомов углерода, алканы представляют собой твердые вещества.
- При увеличении длины углеродной цепи увеличивается и плотность соединения, а также его температуры фазовых переходов первого рода, то есть температуры плавления и кипения.
- Поскольку полярность химической связи в формуле вещества алканов является незначительной, они не растворяются в полярных жидкостях, например, в воде.
- Соответственно их можно использовать в качестве хороших растворителей таких соединений, как неполярные жиры, масла и воски.
- В домашней газовой плите используется смесь алканов, богатая третьим членом химического ряда - пропаном.
- При кислородном горении алканов выделяется большое количество энергии в виде тепла, поэтому эти соединения используют в качестве горючего топлива.
Химические свойства
Ввиду наличия стабильных связей в молекулах алканов, их реакционная способность в сравнении с другими органическими соединениями является низкой.
С ионными и полярными химическими соединениями алканы практически не реагируют. Они ведут себя инертно в растворах кислот и оснований. Алканы вступают в реакцию только с кислородом и галогенами: в первом случае речь идет о процессах окисления, во втором - о процессах замещения. Некоторую химическую активность они проявляют и в реакциях с переходными металлами.
Во всех этих химических реакциях важную роль играют разветвления углеродной цепи алканов, то есть наличие в них радикальных групп. Чем их больше, тем сильнее изменяется идеальный угол между связями 109,47° в пространственной структуре молекулы, что приводит к созданию напряжений внутри нее и, как следствие, увеличивает химическую активность такого соединения.
Реакция простых алканов с кислородом происходит по следующей схеме: C n H 2n+2 + (1,5n+0,5)O 2 → (n+1)H 2 O + nCO 2 .
Пример реакции с хлором приведен на фото ниже.

Опасность алканов для природы и человека

Гептан, пентан и гексан представляют собой легко воспламеняющиеся жидкости и являются опасными как для окружающей среды, так и для здоровья человека, поскольку они токсичны.
Дата: ____________
11-11
Алканы. Гомологический ряд алканов. Номенклатура и изомерия алканов
ТЕМА
ЦЕЛЬ
Дать учащимся понятие о предельных углеводородах, их химическом, пространственном и электронном строении. Ознакомить с понятием гомологии, правилами названия веществ и составления формул по современной номенклатуре. Продолжить формирование мировоззренческих понятий: о познаваемости природы, причинно-следственной зависимости между составом, строением, свойствами и применением предельных углеводородов.
СОДЕРЖАНИЕ
Гомологический ряд алканов и их строение
ТЕРМИНЫ
Алкан, гомологи, изомеры
ХИМ ЭКСПЕРИМЕНТ
ОБОРУДОВАНИЕ
Интерактивная доска
ДОМ ЗАДАНИЕ
ПЛАН УРОКА.
Опрос домашнего задания. Актуализация знаний
Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)
Алканы - углеводороды в молекулах которых все атомы углерода связаны одинарными связями (-) и имеют общую формулу:
C n H 2n+2
Что такое гомологи? (учащиеся отвечают на данный вопрос)
Гомологический ряд алканов
Алканы, имея общую формулу С n H 2 n +2 , представляют собой ряд родственных соединений с однотипной структурой, в котором каждый последующий член отличается от предыдущего на постоянную группу атомов (- CH 2 -). Такая последовательность соединений называется гомологическим рядом (от греч. homolog – сходный), отдельные члены этого ряда – гомологами , а группа атомов, на которую различаются соседние гомологи, – гомологической разностью .
Гомологический ряд алканов легко составить, прибавляя каждый раз к предыдущей цепочке новый атом углерода и дополняя его оставшиеся валентности до 4-х атомами водорода. Другой вариант – добавление в цепь группы -СН 2 -:
CH 4 или Н- СН 2 -Н – первый член гомологического ряда – метан
(содержит 1 атом углерода);
CH 3 - CH 3 или Н- СН 2 -СН 2 -Н – 2-й гомолог – этан (2 атома С);
CH 3 - CH 2 - CH 3 или Н- СН 2 -СН 2 -СН 2 -Н – 3-й гомолог – пропан (3 атома С);
CH 3 - CH 2 - CH 2 - CH 3 или Н- СН 2 -СН 2 -СН 2 - СН 2 - Н – бутан (4 атома С)
Суффикс -ан является характерным для названия всех алканов. Начиная с пятого гомолога, название алкана образуется из греческого числительного, указывающего число атомов углерода в молекуле, и суффикса –ан : пентан С 5 Н 12 , гексан С 6 Н 14 , гептан С 7 Н 16 , октан С 8 Н 18 , нонан С 9 Н 20 , декан С 10 Н 22 и т.д.
Виды изомерии для алканов:
Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами .
Различия в порядке соединения атомов в молекулах (т. е. в химическом строении) приводят к структурной изомерии . Строение структурных изомеров отражается структурными формулами. В ряду алканов структурная изомерия проявляется при содержании в цепи 4-х и более атомов углерода, т. е. начиная с бутана С 4 Н 10 . Если в молекулах одинакового состава и одинакового химического строения возможно различное взаимное расположение атомов в пространстве, то наблюдается пространственная изомерия (стереоизомерия) . В этом случае использование структурных формул недостаточно и следует применять модели молекул или пространственные (стереохимические) формулы. Алканы, начиная с этана С 2 Н 6 , существуют в различных пространственных формах, обусловленных внутримолекулярным вращением по s-связям С–С, и проявляют так называемую поворотную изомерию .
Кроме того, при наличии в молекуле 7-ми и более углеродных атомов, возможен еще один вид пространственной изомерии, когда два изомера относятся друг к другу как предмет и его зеркальное изображение (подобно тому, как левая рука относится к правой).
Такие различия в строении молекул называют зеркальной или оптической изомерией.
Алгоритм.
1. Выбор главной цепи:

2. Нумерация атомов главной цепи:

3. Формирование названия:

2 - метилбутан
Строение алканов.
Атом углерода во всех органических веществах находится в "возбуждённом" состоянии, т. е. Имеет на внешнем уровне четыре неспаренных электрона.
Каждое электронное облако обладает запасом энергии: s- облако имеет менший запас энергии, чем р-облако, в атоме углерода они находятся в разных энергетических состояниях. Поэтому при образовании химической связи происходит гибридизация, т. е. выравнивание электронных облаков по запасу энергии. Это отображается наформе и направленности облаков, происходит перестройка (пространственная) электронных облаков.
В результате sp3 - гибридизации все четыре валентных электронных облака гибридизованы: валентный угол между этими осями гибридизованных облаков 109° 28", поэтому молекулы имеют пространственную тетраэдрическую форму, форма углеродных цепей зигзагообразна; атомы углерода не находятся на одной прямой, т. к. при вращении атомов валентные углы остаются прежними.
Все органические вещества построены в основном за счёт ковалентных связей. Углерод - углеродные и углерод - водородные связи относятся к сигма - связям - это связь, образующаяся при перекрывании атомных орбиталей по линии, проходящей через ядра атомов. Возможно вращение вокруг сигма - связей, поскольку эта связь имеет осевую симметрию.
Для закрепления материала ответить на вопросы в конце параграфа, а также выполнить задания по задачнику
Домашнее задание: §3.1 пересказ, №3,4,6,8 стр. 67
Алканы :
Алканы - это предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. Формула -
Физические свойства :
- Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
- При нормальных условиях неразветвлённые алканы с CH 4 до C 4 H 10 - газы; с C 5 H 12 до C 13 H 28 - жидкости; после C 14 H 30 - твёрдые тела.
- Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан - жидкость, а неопентан - газ.
Химические свойства:
· Галогенирование
это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атому галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно - за один этап замещается не более одного атома водорода:
- CH 4 + Cl 2 → CH 3 Cl + HCl (хлорметан)
- CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (дихлорметан)
- CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (трихлорметан)
- CHCl 3 + Cl 2 → CCl 4 + HCl (тетрахлорметан).
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, забирая у них атом водорода, в результате этого образуются метильные радикалы ·СН 3 , которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
· Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH 4 + 2O 2 → CO 2 + 2H 2 O + Q
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).
В общем виде реакцию горения алканов можно записать следующим образом:
С n Н 2n +2 +(1,5n +0,5)O 2 = n CO 2 + (n +1)H 2 O
· Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
CH 4 → C + 2H 2 (t > 1000 °C)
C 2 H 6 → 2C + 3H 2
Алкены :
Алкены-это непредельные углеводороды,содержащие в молекуле,кроме одинарных связей,одну двойную углерод-углеродную связь.Формула- C n H 2n
Принадлежность углеводорода к классу алкенов отражают родовым суффиксом –ен в его названии.
Физические свойства :
- Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
- При нормальных условиях алкены с C 2 H 4 до C 4 H 8 - газы; с C 5 H 10 до C 17 H 34 - жидкости, после C 18 H 36 - твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Химические свойства :
· Дегидратация -это процесс отщепления молекулы воды от молекулы органического соединения.
· Полимеризация -это химический процесс соединения множества исходных молекул низкомолекулярного вещества в крупные молекулы полимера.
Полимер -это высокомолекулярное соединение,молекулы которого состоят из множества одинаковых структурных звеньев.
Алкадиены :
Алкадиены -это непредельные углеводороды, содержащие в молекуле,кроме одинрных связей,дведвойные углерод-углеродные связи.Формула-
. Диены являются структурными изомерамиалкинов.Физические свойства :
Бутадие́н - газ (tкип −4,5 °C), изопрен - жидкость, кипящая при 34 °C, диметилбутадиен - жидкость, кипящая при 70 °C. Изопрен и другие диеновые углеводороды способны полимеризоваться в каучук. Натуральный каучук в очищенном состоянии является полимером с общей формулой (С5Н8)n и получается из млечного сока некоторых тропических растений.
Каучук хорошо растворим в бензоле, бензине, сероуглероде. При низкой температуре становится ломким, при нагревании липким. Для улучшения механических и химических свойств каучука его превращают в резину, подвергая вулканизации. Для получения резиновых изделий сначала их формуют из смеси каучука с серой, а также с наполнителями: сажей, мелом, глиной и некоторыми органическими соединениями, служащими для ускорения вулканизации. Затем изделия нагревают - горячая вулканизация. При вулканизации сера химически связывается с каучуком. Кроме того, в вулканизированном каучуке сера содержится в свободном состоянии в виде мельчайших частиц.
Диеновые углеводороды легко полимеризуются. Реакция полимеризации диеновых углеводородов лежит в основе синтеза каучука. Вступают в реакции присоединения (гидрирование, галогенирование, гидрогалогенирование):
H 2 C=CH-CH=CH 2 + H 2 -> H 3 C-CH=CH-CH 3
Алкины :
Алкины-этонепредельные углеводороды молекулы которых содержат,помимо одинарных связей,одну тройную углерод-глеродную связь.Формула-C n H 2n-2
Физические свойства :
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С 4) - газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах.
Алкины плохо растворимы в воде, лучше - в органических растворителях.
Химические свойства :
· Реакции галогенирования
Алкины способны присоединять одну или две молекулы галогена с образованием соответствующих галогенпроизводных:
· Гидратация
В присутствии солей ртути алкины присоединяют воду с образованием ацетальдегида (для ацетилена) или кетона (для прочих алкинов)
 алканом
или парафином
(историческое название, которое также имеет другие значения), является ациклический насыщенный углеводород. Другими словами, алкан состоит из водорода и атомов углерода, расположенных в древовидной структуре, в которой все углерод-углеродные связи являются одиночными.
алканом
или парафином
(историческое название, которое также имеет другие значения), является ациклический насыщенный углеводород. Другими словами, алкан состоит из водорода и атомов углерода, расположенных в древовидной структуре, в которой все углерод-углеродные связи являются одиночными.
Алканы имеют общую химическую формулу C n H 2n + 2 . Алканы варьируются по сложности от простейшего случая метана, CH 4 , где n = 1 (иногда называемая исходной молекулой), до сколь угодно больших молекул.
Химическая структура метана, простейший алканКроме этого стандартного определения названная Международным союзом теоретической и прикладной химии, в использовании некоторых авторов термин алкана применяется к любому насыщенному углеводороду, в том числе те, которые являются либо моноциклическими (т.е. циклоалканы) или полициклическими.
В алкане, каждый атом углерода имеет 4 связи (либо С-С или С-Н), и каждый атом водорода присоединен к одному из атомов углерода (как в С-Н-связи). Самая длинная серия связанных атомов углерода в молекуле известна как ее углеродный скелет или углеродная основа. Число атомов углерода можно рассматривать как размер алкана.
Одна группа высших алканов представляет собой воски, твердые вещества при стандартных температуре окружающей среды и давлении (СТиДОС(Стандартная температура и давление окружающей среды)), для которых число атомов углерода в углеродной цепи больше, что примерно в 17 раз.
С повторными -CH 2 — звеньями алканы составляют гомологичный ряд органических соединений, в которых группы отличаются молекулярной массой кратным 14,03 мк (общая масса каждой такой метиленовой звеновой единицы, которая содержит единственный атом углерода с массой 12,01 мк и два атома водорода с массой ~ 1,01 мк каждый).
Алканы не очень реакционноспособны и обладают небольшой биологической активностью. Их можно рассматривать как молекулярные деревья, на которых могут быть подвешены более активные / реакционноспособные функциональные группы биологических молекул.
Алканы имеют два основных источника: нефть (сырая нефть) и природный газ.
Алкильная группа, обычно сокращенно обозначаемая символом R, представляет собой функциональную группу, которая, подобно алкану, состоит исключительно из связанных атомов ациклически связанных атомов углерода и водорода, например метильной или этильной группы.
Структура классификации

Насыщенными углеводородами являются углеводороды, имеющие только отдельные ковалентные связи между их атомами углерода. Они могут представлять:
- Линейную (общая формула C n H 2n + 2), в которой атомы углерода соединены в змееподобной структуреe.
- Разветвленную (общую формулу C n H2 n + 2 , n> 2), где углеродный скелет отщепляется в одном или нескольких направлениях.
- Циклическую (общую формулу C n H 2n , n> 3), где углеродная цепь связана с образованием петли.
Изобутана для 2-метилпропана
Изопентан для 2-метилбутана
Неопентана для 2,2-диметилпропана.
Химические свойства алканов
— вы можете изучить по данной , в полном, понятном изложении.
Физические свойства алканов
Все алканы бесцветны и не имеют запаха.
Таблица алканов.
| Алкан | Формула | Точка кипения [° C] | Точка плавления [° C] | Плотность [г · см-3] (при 20 ° C) |
| Метан | CH 4 | −162 | −182 | Газ |
| Этан | C 2 H 6 | -89 | −183 | Газ |
| Пропан | C 3 H 8 | −42 | −188 | Газ |
| Бутан | C 4 H 10 | 0 | −138 | 0.626 |
| Пентан | C 5 H 12 | 36 | −130 | 0.659 |
| Гексан | C 6 H 14 | 69 | −95 | 0.684 |
| Гептан | C 7 H 16 | 98 | −91 | 0.684 |
| Октан | C 8 H 18 | 126 | −57 | 0.718 |
| Нонан | C 9 H 20 | 151 | −54 | 0.730 |
| Декан | C 10 H 22 | 174 | −30 | 0.740 |
| Ундекан | C 11 H 24 | 196 | -26 | 0.749 |
| Додекан | C 12 H 26 | 216 | −10 | 0.769 |
| Пентадекан | C 15 H 32 | 270 | 10-17 | 0.773 |
| Гексадекан | C 16 H 34 | 287 | 18 | Твердый |
| Эйкозан | C 20 H 42 | 343 | 37 | Твердый |
| Триконтан | C 30 H 62 | 450 | 66 | Твердый |
| Тетроконтан | C 40 H 82 | 525 | 82 | Твердый |
| Пентоконтан | С 50 H 102 | 575 | 91 | Твердый |
| Гексоконтан | C 60 H 122 | 625 | 100 | Твердый |
Точка кипения
Алканы испытывают межмолекулярные силы Ван-дер-Ваальса. Более сильные межмолекулярные силы Ван-дер-Ваальса вызывают более высокие точки кипения алканов.
Для силы Ван-Дер-Ваальсовых сил существует два детерминанта:
- Число электронов, окружающих молекулу, которое увеличивается с молекулярной массой алкана
- Площадь поверхности молекулы

В стандартных условиях от CH 4 до C 4 H 10 алканы являются газообразными; От C 5 H 12 до C 17 H 36 они являются жидкостями; И после C 18 H 38 они являются твердыми. По мере того как температура кипения алканов в первую очередь определяются по весу, она не должна быть неожиданностью, что точка кипения имеет почти линейную зависимость с размером (молекулярная масса) молекулы. Как правило, температура кипения повышается на 20-30 ° C для каждого углерода, добавляемого в цепь. Это правило применяется и к другим гомологичным рядам.
В физической химии силы Ван-дер-Ваальса (или ван-дер-ваальсово взаимодействие), названные в честь голландского ученого Йоханнеса Дидерика Ван дер Ваальса, являются остаточными силами притяжения или отталкивания между молекулами или атомными группами, которые не возникают из ковалентных связей. Можно показать, что силы Ван-дер-Ваальса имеют то же происхождение, что и эффект Казимира, обусловленный квантовыми взаимодействиями с полем нулевой точки. Возникающие в результате силы Ван-дер-Ваальса могут быть притягивающими или отталкивающими.
Прямоцепной алкан будет иметь точку кипения выше, чем алкан с разветвленной цепью из-за большей площади поверхности, находящейся в контакте, таким образом, большие силы Ван-дер-Ваальса между соседними молекулами. Например, сравните изобутан (2-метилпропан) и н-бутан (бутан), которые кипят при -12 и 0 ° С, и 2,2-диметилбутан и 2,3-диметилбутан, которые кипят при 50 и 58 ° С, соответственно. В последнем случае две молекулы 2,3-диметилбутана могут «защелкиваться» друг с другом лучше, чем крестообразный 2,2-диметилбутан, поэтому большие силы Ван-дер-Ваальса
С другой стороны, циклоалканы, как правило, имеют более высокие точки кипения, чем их линейные аналоги из-за заблокированных конформаций молекул, которые дают плоскость межмолекулярного контакта.
Точки плавления
Точки плавления алканов имеют сходную тенденцию к точкам кипения по той же причине, что и выше. То есть, (при прочих равных условиях) тем больше молекуле, тем выше температура плавления. Существует одно существенное различие между точками кипения и температурами плавления. Твердые вещества имеют более жесткую и фиксированную структуру, чем жидкости. Эта жесткая структура требует энергию для разрушения. Таким образом, для лучшего соединения твердых структур потребуется больше энергии для разрыва. Для алканов это видно на графике выше (то есть на зеленой линии). Нечетные алканы имеют более низкую тенденцию к плавлению, чем четные алканы. Это объясняется тем, что даже пронумерованные алканы хорошо укладываются в твердой фазе, образуя хорошо организованную структуру, которая требует больше энергии для разрыва. Алканы с нечетными номерами укладываются хуже, и поэтому организованная структура уплотнения с более «рыхлой» требует меньше энергии для разрыва.
Точки плавления алканов с разветвленной цепью могут быть либо выше, либо ниже, чем у соответствующих алканов с прямой цепью, опять же в зависимости от способности рассматриваемого алкана хорошо укладываться в твердой фазе: это особенно справедливо для изоалканов (2 -метильные изомеры), которые часто имеют температуры плавления выше, чем температуры линейных аналогов.
Проводимость и растворимость
Алканы не проводят электричество и не поляризуются электрическим полем. По этой причине они не образуют водородных связей и нерастворимы в полярных растворителях, таких как вода. Поскольку водородные связи между отдельными молекулами воды выровнены вдали от молекулы алкана, сосуществование алкана и воды приводит к увеличению молекулярного порядка (уменьшение энтропии). Поскольку между молекулами воды и молекулами алкана нет значительного сцепления, второй закон термодинамики предполагает, что это уменьшение энтропии должно быть минимизировано путем сведения к минимуму контакта между алканом и водой: алканы, как говорят, являются гидрофобными в том смысле, что они отталкивают воду.
Их растворимость в неполярных растворителях относительно хорошая, свойство, которое называется липофильностью. Различные алканы, например, смешиваются во всех пропорциях между собой.
Плотность алканов обычно увеличивается с числом атомов углерода, но остается меньше, чем у воды. Следовательно, алканы образуют верхний слой в качестве алкана-водной смеси.
Молекулярная геометрия

Молекулярная структура алканов непосредственно влияет на их физические и химические характеристики. Он получен из электронной конфигурации углерода, которая имеет четыре валентных электрона. Атомы углерода в алканов всегда sp 3 гибридизовали, то есть, что валентные электроны, как говорят, в четырех эквивалентных орбиталей, полученных из комбинации 2 s орбитальных и трех 2р-орбиталей. Эти орбитали, имеющие одинаковые энергии, расположены пространственно в виде тетраэдра, угол между ними cos -1 (- 1/3) ≈ 109,47 °.
Длины связей и валентные углы
Молекула алкана имеет только одинарные связи C-H и C-C. Первые являются следствием перекрытия sp 3 орбитали углерода с 1s-орбиталью водорода; Последний — перекрытием двух sp 3 -орбиталей на разных атомах углерода. Длины связей составляют 1,09 × 10 -10 м для связи C-H и 1,54 × 10 -10 мкм для связи C-C.
Пространственное расположение связей похоже на пространственное расположение четырех sp3-орбиталей — они расположены тетраэдрически с углом 109,47 ° между ними. Структурные формулы, которые представляют собой облигацию как под прямым углом друг к другу, в то время как и общие и полезные, не соответствуют действительности.
Конформация
Структурная формула и углы связи обычно недостаточны для полного описания геометрии молекулы. Существует еще одна степень свободы для каждого углерод-углеродной связи: торсионный угол между атомами или группами, связанными с атомами на каждом конце связи. Пространственное расположение, описываемое углами кручения молекулы, известно как его форма.
Этан образует простейший случай для изучения конформации алканов, так как существует только одна связь C-C. Если посмотреть вниз по оси C-C-связи, то увидите так называемую проекцию Ньюмана. Атомы водорода как на переднем, так и на заднем углеродном атоме имеют угол 120 ° между ними, что обусловлено проекцией основания тетраэдра на плоскую плоскость. Однако угол кручения между данным атомом водорода, присоединенным к переднему углероду, и заданным атомом водорода, присоединенным к заднему углероду, может свободно изменяться от 0 ° до 360 °. Это является следствием свободного вращения вокруг простой углерод-углеродной связи. Несмотря на эту кажущуюся свободу, важны только две предельные конформации: затменная конформация и ступенчатая конформация.
 Шариковые и двухшнековые модели двух ротамеров этана
Шариковые и двухшнековые модели двух ротамеров этана
Две конформации, также известные как ротамеры, различаются по энергии: шахматная конформация составляет 12,6 кДж / моль ниже по энергии (более стабильной), чем затмеваемая конформация (наименее стабильная).
Это различие в энергии между двумя конформациями, называемое энергией кручения, мало по сравнению с тепловой энергией молекулы этана при температуре окружающей среды. Постоянное вращение вокруг связи C-C. Время, необходимое для перехода молекулы этана из одной шахматной конформации в другую, что эквивалентно вращению одной группы СН3 на 120 ° относительно другой, составляет порядка 10 -11 с.
 Проекции двух конформаций этана: затмивление на левой стороне, в шахматном порядке справа.
Проекции двух конформаций этана: затмивление на левой стороне, в шахматном порядке справа.
Высшие алканы является более сложные, но основанные на аналогичных принципах, при этом антиперипланарная конформация всегда наиболее благоприятна вокруг каждой углерод-углеродной связи. По этой причине алканы обычно показаны зигзагообразно на диаграммах и в моделях. Фактическая структура всегда будет несколько отличаться от этих идеализированных форм, так как различия в энергии между конформациями малы по сравнению с тепловой энергией молекул, так как молекулы алканов не имеют фиксированной структурной формы, независимо от того, что может показывать модель.
Спектроскопические свойства
Практически все органические соединения содержат углерод-углеродные и углерод-водородные связи и поэтому показывают некоторые особенности алканов в их спектрах. Алканы отличаются отсутствием других групп и, следовательно, отсутствием других характерных спектроскопических признаков различных функциональных групп, таких как -ОН, -CHO, -COOH и т.д.
Инфракрасная спектроскопия
Углеродно-водородный метод растяжения дает сильное поглощение между 2850 и 2960 см -1 , в то время как углерод-углеродный режим растяжения поглощает от 800 до 1300 см -1 . Методы изгиба углерод-водород зависят от природы группы: метильные группы показывают полосы при 1450 см -1 и 1375 см -1 , в то время как метиленовые группы показывают полосы при 1465 см -1 и 1450 см -1 . Углеродные цепи с более чем четырьмя атомами углерода демонстрируют слабое поглощение при температуре около 725 см -1 .
ЯМР-спектроскопия
Протон-резонансы алканов обычно обнаруживаются при δH = 0,5-1,5. Резонансы углерода 13 зависят от числа атомов водорода, связанных с углеродом: δ C = 8-30 (первичный, метил, -CH 3), 15-55 (вторичный, метилен, -CH 2 -), 20-60 (третичный, Метин, С-Н) и четвертичный. Углерод-13-резонанс четвертичных атомов углерода характеризуется слабостью из-за отсутствия ядерного эффекта Оверхаузера и длительным временем релаксации и может быть пропущен в слабых образцах или образцах, которые не были проработаны в течение достаточно длительного времени.
Масс-спектрометрия
Алканы обладают высокой энергией ионизации, а у молекулярной ион обычно слабый. Фрагментацию фрагментации может быть трудно интерпретировать, но в случае разветвленных алканов углеродная цепь предпочтительно расщепляется на третичных или четвертичных углеродах из-за относительной стабильности полученных свободных радикалов. Фрагмент, являющийся результатом потери одной метильной группы (М-15), часто отсутствует, а другой фрагмент часто отделен интервалами четырнадцати массовых единиц, что соответствует последовательной потере СН 2 -групп.
Способы получения алканов
О способах получения алканов, вы так же сможете узнать и изучить по данной .